En las representaciones de Lewis no se observan ninguna diferencia entre los enlaces de algún tipo y otro. Sin embargo, las interacciones entre elementos dependen de las propiedades de cada uno, por ejemplo si un enlace es fuerte, débil, soluble en agua, duro o blando, conductor de corriente, etc depende de las propiedades periódicas:
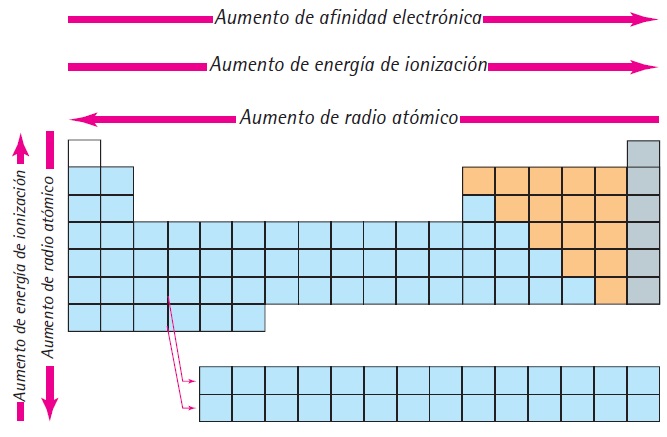
- RADIO ATÓMICO: Es la distancia promedio que hay entre el núcleo y los electrones de valencia de un átomo entre menos sea el radio de un átomo y los electrones de valencia sienten una mayor atracción por el núcleo esto impacta en otras propiedades que dependerán de la carga nuclear efectiva.
- AFINIDAD ELECTRÓNICA: Es la energía liberada cuando un átomo gana un electrón por encima de los electrones de valencia. Es lógico que entre más pequeño es un átomo los electrones exteriores sienten mas influencia por el núcleo, por lo tanto en una tabla periódica la afinidad electrónica crece en el sentido inverso al radio.
- ENERGÍA DE IONIZACIÓN: Es la energía necesaria para que un átomo pierda un electrón de valencia. Es natural que un elemento entre mas afín sea por electrones mas energía de ionización requerirá para extraer un electrón, por lo tanto en una tabla periódica la energía de ionización crece en el mismo sentido que la afinidad electrónica.
- ELECTRONEGATIVIDAD: Es la capacidad que tiene un átomo por atraer electrones, a diferencia de la afinidad electrónica y energía de ionización, la electronegatividad es una variable que depende del ambiente químico en el que se encuentra un elemento, eso significa que si dos átomos de un mismo elemento se encuentran enlazados a disintos grupos enran diferentes elecronegaividades.

No hay comentarios:
Publicar un comentario